変形性膝関節症における限局性軟骨欠損患者を対象とした同種培養軟骨細胞キットの有効性及び安全性に関する探索的臨床試験
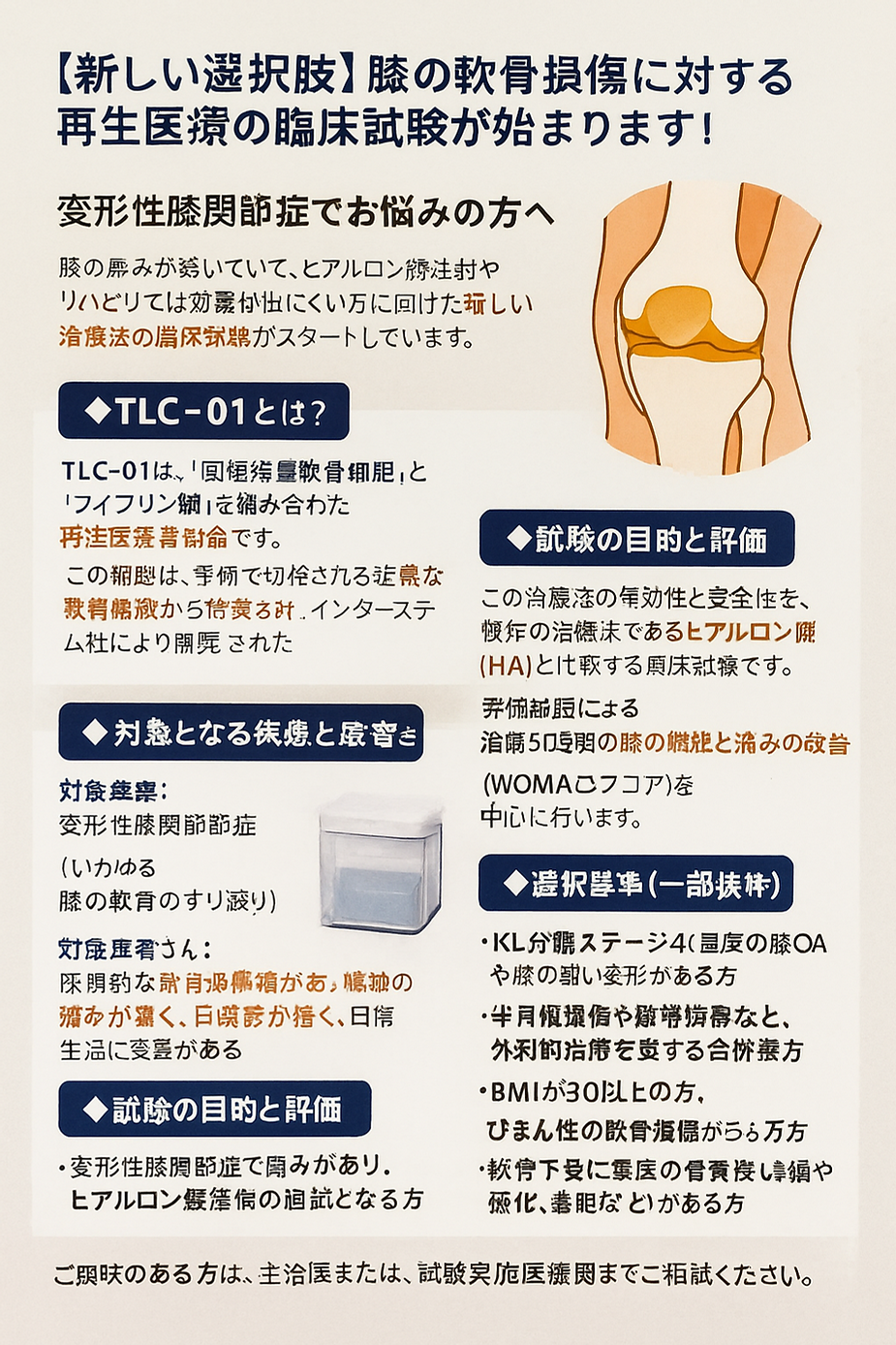
変形性膝関節症でお悩みの方へ
膝の痛みが続いていて、リハビリでは効果が出にくい方に向けた新しい治療法の臨床試験がスタートしています。
◆ TLC-01とは?
TLC-01は、「同種培養軟骨細胞」と「フィブリン糊」を組み合わせた再生医療製品です。
この細胞は、手術で切除された正常な軟骨組織から培養され、インターステム社により開発されました。
従来のように膝を大きく切開する必要はなく、関節鏡や小さな切開による低侵襲での移植が可能です。
◆ 対象となる疾患と患者さん
対象疾患: 変形性膝関節症(いわゆる膝の軟骨のすり減り)
対象患者さん:
-
限局的な軟骨損傷があり、膝の痛みが強く、日常生活に支障がある方
-
MRIで損傷部位の面積が2~18cm²と確認されている方
-
3ヶ月以上保存的治療をしても改善がみられなかった方
-
ヒアルロン酸注射の適応があると診断されている方
-
18歳以上の方(性別不問)
◆ 試験の目的と評価
この治療法の有効性と安全性を、既存の治療法である**ヒアルロン酸注射(HA)**と比較する臨床試験です。
評価指標は、治療後52週間の膝の機能と痛みの改善度(WOMACスコア)を中心に行います。
◆ 選択基準(一部抜粋)
-
変形性膝関節症で痛みがあり、ヒアルロン酸注射の適応となる方
-
軟骨損傷が限局しており、合計18cm²以下の損傷がある方
-
保存的治療(理学療法など)で改善しなかった方
◆ 除外基準(一部抜粋)
-
KL分類ステージ4(重度の膝OA)や膝の強い変形がある方
-
半月板損傷や靱帯損傷など、外科的治療を要する合併疾患がある方
-
BMIが30以上の方、びまん性の軟骨損傷がある方
-
軟骨下骨に重度の骨異常(浮腫や硬化、嚢胞など)がある方
ご興味のある方は、主治医または治験担当医師までご相談ください。
治験責任医師 内田宗志 (再生医療学会認定医)
ご興味のある方は、主治医または本試験実施医療機関までご相談ください。
変形性膝関節症でお悩みの方へ 膝の痛みが続いていて、ヒアルロン酸注射やリハビリでは効果が出にくい方に向けた新しい治療法の臨床試験がスタートしています。 ◆ TLC-01とは? TLC-01は、「同種培養軟骨細胞」と「フィブリン糊」を組み合わせた再生医療製品です。 この細胞は、手術で切除された正常な軟骨組織から培養され、インターステム社により開発されました。 従来のように膝を大きく切開する必要はなく、関節鏡や小さな切開による低侵襲での移植が可能です。 ◆ 対象となる疾患と患者さん 対象疾患: 変形性膝関節症(いわゆる膝の軟骨のすり減り) 対象患者さん: 限局的な軟骨損傷があり、膝の痛みが強く、日常生活に支障がある方 MRIで損傷部位の面積が2~18cm²と確認されている方 3ヶ月以上保存的治療をしても改善がみられなかった方 ヒアルロン酸注射の適応があると診断されている方 18歳以上の方(性別不問) ◆ 試験の目的と評価 この治療法の有効性と安全性を、既存の治療法である**ヒアルロン酸注射(HA)**と比較する臨床試験です。 評価指標は、治療後52週間の膝の機能と痛みの改善度(WOMACスコア)を中心に行います。 ◆ 選択基準(一部抜粋) 変形性膝関節症で痛みがあり、ヒアルロン酸注射の適応となる方 軟骨損傷が限局しており、合計18cm²以下の損傷がある方 保存的治療(理学療法など)で改善しなかった方 ◆ 除外基準(一部抜粋) KL分類ステージ4(重度の膝OA)や膝の強い変形がある方 半月板損傷や靱帯損傷など、外科的治療を要する合併疾患がある方 BMIが30以上の方、びまん性の軟骨損傷がある方 軟骨下骨に重度の骨異常(浮腫や硬化、嚢胞など)がある方 ご興味のある方は、主治医または本試験実施医療機関までご相談ください。
.jpg)
